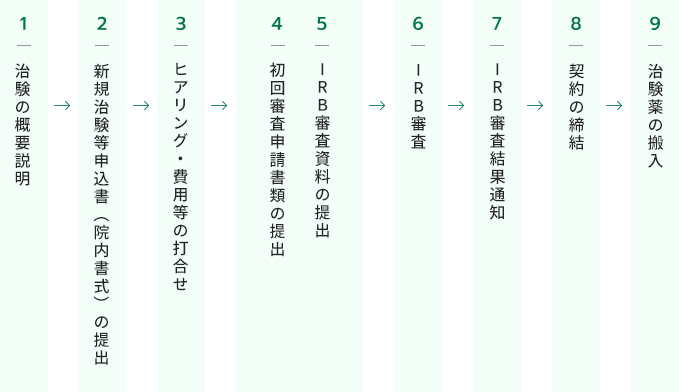
1治験の概要説明
新規の治験・製造販売後臨床試験を依頼される場合、臨床研究支援センターにて、治験概要などの説明(CRC、事務担当者を対象)をお願いします。主な内容は、試験デザイン、対象疾患、診療科、責任医師予定者、症例数、治験期間等です。
2新規治験等申込書(院内書式)の提出
新規治験ご依頼時、「新規治験等申込書」(ホームページ様式集に掲載)を提出してください。ご提出いただいた後、契約書のひな型等を電子データにてお送りします。
3ヒアリング・費用等の打合せについて
ヒアリング及び費用等の打合せ実施日は、原則として IRB審査月の前月第2水曜・木曜です。
(「ヒアリング実施予定日と書類提出締切日」参照)
ヒアリング及び費用等の打合せの資料は実施日の10営業日前(土日祝日を除く)までに提出してください。(「提出書類について」 I参照)
治験薬管理表、治験薬処方印等は担当 CRCと相談してください。
ヒアリングでは治験薬管理者、担当CRC(外部委託のCRC を含む)にプロトコールについて説明をしていただき、同意説明文書の最終確認を行います。
ヒアリングで修正等指摘があった場合
- 修正分を担当CRCへメール(添付ファイル)で提出してください。
- 同意説明文書については、修正履歴は必要ありませんが、修正箇所のみ赤字にて表記してください。
費用等の打合せでは課長、事務担当者が出席し、ポイント算出表や治験で発生する費用等についての最終確認を行います。
4初回審査申請書類の提出
初回審査申請書類をIRB開催日の14日前(第1火曜)までに提出してください。(「提出書類について」Ⅱ-1参照)
5IRB審査用資料の提出
IRBでの審査時に必要な資料は2種類あります。いずれもIRB開催日の14日前(第1火曜)までに提出してください。(「提出書類について」Ⅱ-2.4.5.参照)
- 1 ) IRB審査用資料(プロトコール等一式を紙ファイルに綴じたもの:20部及び外部委員送付用資料 3部)
- 2 ) 試験全体の説明資料(パワーポイントで作成し、2 アップ両面印刷):25部
※上記部数には説明医師分は含まれません。
IRBでは責任医師または分担医師のいずれか(以下、「説明医師」という。)に2)に基づいて、試験全体について説明していただきますので、事前に説明医師に対し、IRB当日の出席が必要な旨をお伝えいただいた上で、上記1)、2)の資料を別途お送りいただき、IRB当日持参するよう依頼いただきますようお願いします。
6IRBでの審査
IRBにて、説明医師に5分程度で試験全体について説明していただきます。
7IRBの審査結果について
IRBの審査後、事務局より審査結果速報(承認、修正の上承認等)をメールでお知らせします。
委員会の記録を確認した後、1~2日以内に改めて審査結果詳細をメールにてお知らせします。修正の上承認の場合、指摘事項を踏まえ、「治験実施計画書等修正報告書」と修正後の書類(同意説明文書本体、変更対比表等)を提出してください。
治験審査結果通知書は審査月の月末頃に発送いたします。
8契約の締結
契約締結日は、IRB承認月の翌月1日以降です。
契約書等書類は、社印を押印の上、提出してください。
「袋とじ」となる契約書の契印は、最終ページのみで構いません。
9治験薬の搬入
治験薬管理補助者と治験薬搬入の日程を相談してください。



